กรดอะมิโน และ พันธะเปปไทด์
โครงสร้างกรดอะมิโน
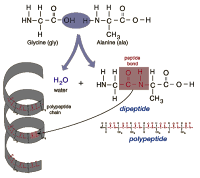
พันธะเพปไทด์
| การเรียกชื่อของพันธะเพปไทด์ | ||
| จำนวนกรดอะมิโน | จำนวนพันธะเพปไทด์ | ชื่อสาร |
| 2 | 1 | ไดเพปไทด์ (dipeptide) |
| 3 | 2 | ไตรเพปไทด์ (tripeptide) |
| 4 | 3 | เตตระเพปไทด์ (terapeptide) |
| ตั้งแต่ 10-50 | 9-49 | พอลีเพปไทด์ |
| 50 ขึ้นไป | มากกว่า 49 | โปรตีน |
โครงสร้างของโปรตีน
โปรตีนส่วนใหญ่เป็นพอลิเพปไทด์ที่มีมวลโมเลกุลมากกว่า 5,000 ซึ่งประกอบด้วยกรดอะมิโนหลายชนิดและมีจำนวนแตกต่างกัน ยึดเหนี่ยวกันด้วยพันธะเพปไทด์และพันธะชนิดอื่นๆ ทำให้โปรตีนมีโครงสร้าง 4 ระดับ (โดยใช้โครงสร้างทางเคมีเป็นเกณฑ์) ดังนี้โครงสร้างปฐมภูมิ (primary structure)
เช่น Gly-Ala-Tyr-His อ่านว่า glycylalanyltyrosylhistidine
โครงสร้างทุติยภูมิ (secondary structure)
-
โครงสร้างทุติยภูมิเป็นโครงสร้างที่เกิดจากการขดหรือม้วนตัวของโครงสร้างปฐมภูมิ โดยโครงสร้างทุติยภูมิมี 3 ส่วน คือ
- ส่วนที่เป็นเกลียวแอลฟา (alpha helix)
- ส่วนที่เป็นแผ่นพลีทบีต้า (Beta-pleated sheet)
- ส่วนที่ไม่ใช่เกลียวแอลฟา (Random coil)
โครงสร้างตติยภูมิ (tertiary structure)
- เกิดจากโครงสร้างเกลียวแอลฟา (alpha helix) แผ่นพลีทบีต้า (Beta-pleated sheet ) และบริเวณที่ไม่ใช่เกลียวแอลฟา
- (Random coil) ม้วนเข้าหากันได้โครงสร้าง 3 มิติ และไขว้กันโดยมีแรงยึดเหนี่ยวอ่อน ๆ คล้ายโครงสร้างทุติยภูมิ
โครงสร้างจตุรภูมิ (Quaternary structure)
ชนิดและหน้าที่ของโปรตีน
| โปรตีนก้อนกลม | โปรตีนเส้นใย |
| เกิดจากสายพอลิเพปไทด์รวมตัวม้วนพับพันกันและอัดแน่นเป็นก้อนกลม | เกิดจากสายพอลิเพปไทด์หลายสายเรียงขนานกันและขดเป็นเกลียวเหมือนเชือก |
| สามารถละลายน้ำได้ดี | สามารถละลายน้ำได้น้อย |
| ส่วนใหญ่ทำหน้าที่เกี่ยวกับกระบวนการเมตาบอลิซึมต่าง ๆ ที่เกิดขึ้นภายในเซลล์ เช่น เอนไซม์ ฮีโมลโกลบิน ฮอร์โมนอินซูลิน เป็นต้น | ส่วนใหญ่ทำหน้าที่เป็นโปรตีนโครงสร้าง เพราะมีความแข็งแรง และยืดหยุ่นสูง เช่น ไฟโบรอินในเส้นไหม อิลาสตินในเอ็น คอลลาเจนในเนื้อเยื่อเกี่ยวพัน เคราตินในเส้นผม ขน เล็บ ไมโอซินในกล้ามเนื้อ เป็นต้น |
สมบัติของโปรตีน
- โปรตีนบริสุทธิ์ ไม่มีรส ไม่มีกลิ่น เมื่อได้รับความร้อนมาก ๆ โปรตีนจะเปลียนเป็นสีน้ำตาลหรือสีดำ และมีกลิ่นคล้ายผม หรือหนังสัตว์ไหม้ ละลายน้ำได้
- โปรตีนจัดเป็นสารแอมโฟเทอริก (เป็นได้ทั้งกรดและเบส) คือปฏิกิริยากับกรดและเบสได้
- หมู่แอลคิลของกรดอะมิโนในโปรตีนอาจเกิดพันธะไฮโดรเจนซึ่งกันและกัน ทำให้เกิดเป็นเกลียวหรือเป็นแผ่น ซึ่งจะมีการขดม้วนตัวโดยอาศัยแรงยึดเหนี่ยวระหว่างกัน เช่น แรงแวนเดอวาลส์ พันธะไฮโดรเจน ทำให้เกิดโครงสร้างสามมิติ
- แรงยึดเหนี่ยวทั้งกล่าวถูกทำลายได้ง่าย จึงทำให้โครงสร้างสามมิติของโปรตีนเปลี่ยนไป เรียกว่า การแปลงสภาพโปรตีน (denatured)
เอนไซม์ (Enzyme)
- เป็นโปรตีนโครงสร้างชนิดก้อนกลม
- ทำหน้าที่เป็นตัวเร่งปฏิกิริยาในเซลล์สิ่งมีชีวิต โดยการลดพลังงานก่อกัมมันต์และทำให้อนุภาคของสารตั้งต้นรวมตัวกับ เอนไซม์ได้อย่างเหมาะสม มีผลให้ปฏิกิริยาเกิดเร็วขึ้น
- มีความจำเพาะต่อปฏิกิริยาหรือมีความจำเพาะต่อสารที่เข้าทำปฏิกิริยาชนิดใดชนิดหนึ่งเท่านั้น เพราะมีรูปร่างที่พอเหมาะกัน พอดีกับตัวรับ (สับสเตรต) อันเป็นผลให้ร่างกายสามารถควบคุมปฏิกิริยาต่าง ๆ ได้อย่างเหมาะสม
การทำงานของเอนไซม์
ปัจจัยที่มีผลต่อการทำงานของเอนไซม์
- ปริมาณสารตั้งต้น
- ปริมาณเอนไซม์
- pH
- อุณหภูมิ
การแปลงสภาพโปรตีน (denatured)
การทำให้โครงสร้างสามมิติของโปรตีนเปลี่ยนแปลงไป เช่น การทำให้เกลียวของโปรตีนคลายออก จะทำให้โครงสร้างของโปรตีนเปลี่ยนแปลงไป สมบัติของโปรตีนก็จะเปลี่ยนแปลงไปด้วย เช่น สมบัติเกี่ยวกับการละลายน้ำ














We are dedicated to offering custom peptide synthesis, process development, GMP manufacturing as well as catalog products for customers in industry and research area. Dipeptide-15
ตอบลบ